再生医療等提供計画書及び添付書類の作成
当事務所の強み
当事務所では、申請書類の作成から運用サポートまでお任せいただけます。
申請受理後1ヶ月間はサポート期間を設けております。
また、必要に応じて医療機関様向けの顧問契約も承っております。
【新規申請後5つのサポート】
①サポート期間中のお電話やメールにて質疑応答
②受理から1ヶ月後に当事務所よりお電話確認
③新規申請受理後の面談もしくはリモートでの説明会の開催
④省令要項を満たした記録用紙の雛形の提供
⑤定期報告1ヶ月前のご案内連絡
上記のサポート費用については、申請代行費用に含みます。
また、申請書類の審査段階や厚生局提出後に修正指示が入る場合もございますが、当事務所では受理されるまで修正対応を行います。
別途費用のご請求はございません。
【行政書士だからこそ出来る事】
再生医療等提供計画の作成は行政書士法により行政書士の独占業務となっております。
当事務所では、代表の私がヒアリング・書類の作成から提出まで行うため、委員会及び厚生局とのやり取りについても全て当事務所にて対応させていただく事が可能です。
申請に必要な情報のご提供以外の部分については全てお任せいただけます。
再生医療等の申請は、実績豊富な当事務所へお任せください!!
再生医療等提供計画について
再生医療等提供計画は、再生医療等の安全性の確保に関する法律にお基づき、再生医療等を実施するために提出する計画書のことを指します。
再生医療等にはそのリスクに応じ第1種・第2種・第3種に分類されており、各分類に応じた提供計画の作成を行います。
この各分類の決め方は、下記の図のように決められています。
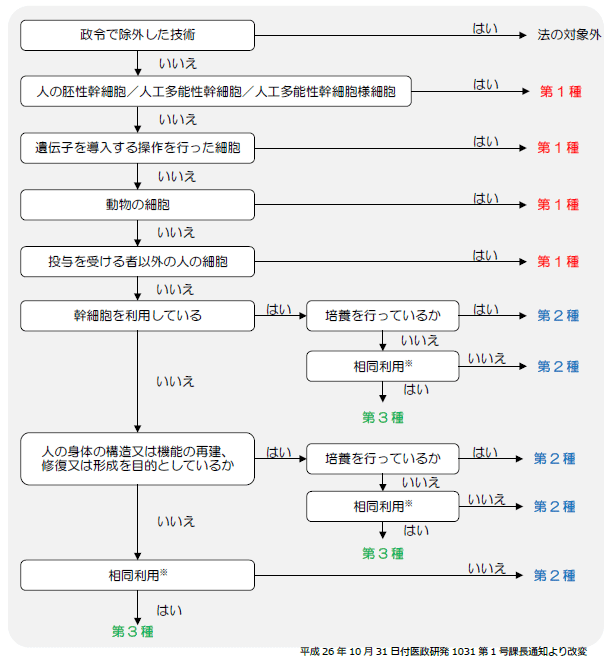
※「相同利用」については、採取した細胞が再生医療等を受ける者の再生医療等の対象となる部位の細胞と同様の機能を持つ細胞の投与方法をいい、例えば、腹部から脂肪細胞を採取し、当該細胞から脂肪組織由来幹細胞を分離して、乳癌の術後の患部に乳房再建目的で投与することは相同利用に該当するが、脂肪組織由来幹細胞を糖尿病の治療目的で経静脈的に投与することは、脂肪組織の再建を目的としていないため相同利用には該当しない。また、末梢血を遠心分離し培養せずに用いる医療技術については、例えば、皮膚や口腔内への投与は相同利用に該当するが、関節腔内等、血流の乏しい組織への投与は相同利用に該当しない。(平成26年10月31日付医政研発1031第1号課長通知より抜粋)
再生医療等提供計画を作成するにあたり必要な書類について
再生医療等提供計画を作成するにあたっては厚生局に押印の上、提出をする様式第一の二という書類の他に、下記の書類を作成する必要があります。
- 認定再生医療等委員会意見書
・再生医療等提供計画に記載した認定再生医療等委員会が述べた意見書の写し
・審査の過程がわかる記録の写し
・当該認定再生医療等委員会が記載した再生医療等提供基準チェックリストの写し - 提供する再生医療等の詳細を記した書類
- 実施責任者及び再生医療等を行う医師又は歯科医師の氏名、所属、役職及び略歴(研究に関する実績がある場合には、当該実績を含む。)を記載した書類
- 再生医療等に用いる細胞の提供を受ける場合にあっては、細胞提供者又は代諾者に対する説明文書及び同意文書の様式(細胞の提供を受ける場合)
- 再生医療等を受ける者に対する説明文書及び同意文書の様式
- 再生医療等提供計画に記載された再生医療等と同種又は類似の再生医療等に関する国内外の実施状況を記載した書類
- 再生医療等に用いる細胞に関連する研究を記載した書類
- 特定細胞加工物概要書、特定細胞加工物標準書、衛生管理基準書、製造管理基準書及び品質管理基準書 (特定細胞加工物を用いる場合)
- 再生医療等製品の添付文書等 (再生医療等製品を用いる場合)
- 再生医療等の内容をできる限り平易な表現を用いて記載したもの
- 委託契約書の写しその他これに準ずるもの (特定細胞加工物の製造を委託する場合)
- 個人情報取扱実施規程
- その他
・再生医療等提供計画の情報の公表に関する同意書
・本文中に掲載しきれない説明書類等
この他に、省令で作成・保管が義務づけられている書類の中に手順書というものがあります。
- 細胞培養加工施設からの特定細胞加工物の提供の管理と取扱いの決定に関する手順書
- 検証又は確認に関する手順書
- 品質の照査に関する手順書
- 変更の管理に関する手順書
- 逸脱の管理に関する手順書
- 品質等に関する情報及び品質不良等の処理に関する手順書
- 重大事態報告等に関する手順書
- 自己点検に関する手順書
- 教育訓練に関する手順書
- 文書及び記録の管理に関する手順書
- 品質リスクマネジメントに関する手順書
再生医療等提供計画の作成から提出までの流れについて
- まずは実施を行おうとする再生医療等が政令で除外された技術でないものであるのか、政令で除外された技術でないものであるならば、再生医療等の分類上第何種に該当するのかについて確認を行います。
- 自施設にて特定細胞加工物を製造する場合には特定細胞加工物製造届出書を作成し、他施設にて特定細胞加工物の製造を委託する場合には契約を交わします。
- 提供を行おうとする再生医療等に関する安全性や妥当性、国内外の実施状況についての論文を検索し、安全性及び妥当性について検討を行います。
- 再生医療等を提供するにあたり、特定細胞加工物の製造に関する製造管理責任者及び品質管理に関する品質管理責任者、苦情相談窓口の担当者を決めます。
- 実施を行う医師(非常勤医師含む)の履歴書を準備します。
- 実施を行う再生医療等の治療に対し、患者さんの選定基準や除外基準について決めます。
- 特定細胞加工物の採取を行う場所、特定細胞加工物の投与を行う場所について決めます。
- 省令にて定められた事項を満たすように添付書類の作成を行います。
- 厚労省の支援サイトから様式1の2の作成を行います。その際に作成した添付書類についても支援サイトにアップロードします。
- 1種・2種であれば特定認定再生医療等委員会へ、第三種であれば認定再生医療等委員会へ作成した再生医療等提供計画について審査を行ってもらうための審査申込を行います。
- 委員会の審査が終わり、委員会より「適」もしくは「可」等の意見書が交付された場合には、委員会から送付される意見書及び審査業務の過程に関する記録及び再生医療等提供基準チェックリストを支援サイトにアップロードします。委員会の審査にて継続審査等になった場合には委員会の指示に従い修正し、再度審査申込を行います。
- 支援サイトから作成した様式1の2をダウンロードし、押印の上で厚生局へ提出します。
- 厚生局から修正指示がある場合には修正を行います。
- 受理をされましたら計画番号が交付されます。
- 再生医療等の実施が可能となります。
上記の通り、再生医療等提供計画については作成する書類も多く、手続自体も煩雑な部分がありますが、再生医療等を提供する場合には必ず再生医療等提供計画の提出が必要になり、違反した場合には罰則もあります。
特定細胞加工物製造状況報告書について
1年に1回、受理日から1年分の特定細胞加工物の製造件数等について毎年厚生局へ報告を行います。
提出期限は、受理日の1年後の60日後までです。例えば2020/1/9受理の場合は2020/1/9~2021/1/8までの記録を2021/3/8頃までに提出する必要があります。また、1年間のうち、途中で廃止届出書を提出した場合には、前回特定細胞加工物製造状況報告書を提出した末日から廃止届を提出した日までの特定細胞加工物の製造件数について特定細胞加工物製造状況報告書を廃止届提出から60日以内に提出する必要があります。
特定細胞加工物の製造に関しての記録しておくべき項目は省令で定められており、作成した記録は10年間保管を行う必要があります。
再生医療等提供計画の変更について
再生医療等提供計画は受理されましたら、記載を行った提供計画通りに運用を行う必要があります。
しかし、運用の過程で変更事項が生じるというケースもあります。
再生医療等提供計画の変更には軽微変更届と委員会の審査が必要な変更届の2種類があります。
軽微変更届の代用的なものとしては
・医師の役職が変更になった
・メールアドレス等が変更になった
などが挙げられます。
実質的には軽微変更届については大きな病院以外ではあまり提出する機会はない場合が多いです。
委員会の審査が必要な変更届の代表的な者としては
・実施を行う医師が増えた
・特定細胞加工物の製造方法を変えた
などが挙げられます。
軽微変更届については委員会の審査は必要ありませんが、医師が追加になったなどの委員会の審査が必要になる変更届については、変更を行う前に委員会の審査を受け、厚生局に変更届を受理される必要があります。
委員会の審査は概ね月に1回開催の委員会が多いため、変更が必要な場合には早めに変更届の作成及び審査申込を行う必要があります。
再生医療等提供状況報告書について
再生医療等提供計画が受理された後は1年に1回、受理日の1年後から90日以内に1年間に実施した再生医療等の件数及び治療の結果について評価を行う必要があります。例えば2020/1/10に受理された計画については2020/1/10~2021/1/9までの実施件数を2021/4/9頃までに提出します。
評価というのは、例えば整形外科領域などであればVASスケールやKOOSスケール、その他画像など、不妊領域であれば子宮内膜の厚さの改善や着床・妊娠の有無などが挙げられます。可能な限り具体的に数値化した上で、再生医療等提供計画を作成した際の添付書類として提出した国内外の同種の治療に関する論文と比較し、安全性及び治療の妥当性・有効性について検討を行ったものを指します。
特定細胞加工物製造状況報告書同様こちらも毎年行う必要があります。

再生医療等の提供を中止する場合について
再生医療等提供計画を提出し、実施を行っていたが、実施を辞めたいという場合には「再生医療等提供中止届」を中止後10日以内に提出する必要があります。
また、再生医療等提供計画の年度途中で中止を行った場合には前回の再生医療等提供状況報告書の末日から中止の日までに実施した再生医療等の実施件数について再生医療等提供状況報告書の提出が必要となります。

